Editing genomico con grafting: è possibile avere piante editate interamente non-OGM?
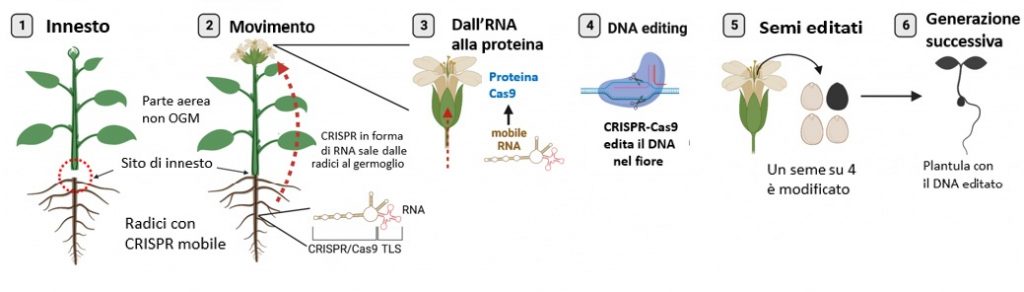
Dall’incontro tra le forbici genetiche CRISPR e l’antica pratica degli innesti nasce l’editing by grafting, cioè l’idea di correggere il genoma impiegando un tipo di CRISPR mobile, capace di spostarsi dalla parte radicale alla parte aerea innestata, che è a tutti gli effetti OGM-free
La pratica degli innesti è antichissima, ne scriveva già Catone il censore oltre duemila anni fa. Le forbici genetiche CRISPR/Cas9 (abbreviate in CRISPR) invece sono un’invenzione giovane, che apre una porta sul futuro. Dall’incontro tra le due tecniche potrebbe sbocciare la soluzione a un problema cruciale, da cui dipende l’accettazione pubblica della più importante delle Tecnologie di evoluzione assistita: come ottenere facilmente piante geneticamente corrette (in gergo si dice editate) e al tempo stesso ripulite da ogni traccia di DNA estraneo, che possano essere considerate e regolamentate in modo diverso dagli OGM.
L’ “editing by grafting”, ovvero l’idea di correggere il genoma usando un portainnesto, presuppone l’impiego di un tipo di CRISPR mobile, capace di spostarsi dalla parte radicale (che ospita il gene estraneo necessario a produrre le forbici genetiche) alla parte aerea innestata (che invece è OGM-free). In accordo con le leggi di Mendel, il 25% dei semi prodotti avranno entrambe le copie del gene di interesse corrette secondo le istruzioni impartite dai ricercatori. Insomma, risulteranno editati senza essere mai stati esposti a DNA estraneo e daranno origine a piante editate interamente non-OGM (a questo link è disponibile un’animazione che illustra il concetto).
L’idea è venuta a un gruppo di ricercatori tedeschi guidato da Friedrich Kragler, lavorando nella cornice del progetto europeo Plamorf che studia i segnali che viaggiano nel sistema vascolare delle piante. Le foglie, ad esempio, devono essere informate di ciò che accade alle radici e viceversa, perciò c’è un via vai di messaggi sotto forma di RNA lungo lo stelo. Per far viaggiare in questo modo le forbici genetiche facendole arrivare alle gemme che daranno origine ai fiori, basta usare CRISPR sotto forma di RNA e legare a questo trascritto una sequenza di trasporto (TLS). In questo modo il pacchetto genetico per il sistema CRISPR presente nel portainnesto produce una variante mobile di CRISPR. Questo RNA salirà lungo lo stelo e una volta giunto a destinazione verrà tradotto nel complesso proteico corrispondente, ovvero le forbici genetiche pronte a tagliare il bersaglio per cui sono state programmate. Sia l’RNA che le proteine vengono rapidamente degradate nelle cellule, quindi dopo aver esaurito il loro compito non resteranno in circolazione. La correzione genetica avverrà nelle cellule madri di polline e cellule uovo e, grazie all’autoimpollinazione, un quarto dei semi la riceverà in doppia copia. Anche se la pianta parentale è parzialmente OGM (perché il portainnesto contiene il gene per le forbici genetiche), le piante figlie non hanno bisogno di innesti e non contengono geni estranei, solo la mutazione desiderata che avrebbe potuto generarsi spontaneamente in natura.
Kragler e colleghi hanno effettuato l’esperimento usando come portainnesto la pianta modello Arabidopsis thaliana e il sistema ha funzionato anche quando la parte innestata apparteneva a una specie diversa (Brassica rapa). Il loro studio è stato pubblicato su Nature Biotechnology nel gennaio 2023.
Abbiamo chiesto a Riccardo Velasco, direttore del Centro di Ricerca in Viticoltura ed Enologia del Consiglio per la Ricerca in Agricoltura e l’Analisi dell’Economia (CREA), di spiegarci le altre opzioni disponibili per produrre piante editate OGM-free. Il quadro che ci ha aiutato a ricostruire è complesso. Supponiamo di riuscire a introdurre il sistema CRISPR in una singola cellula di partenza sotto forma di DNA, con l’aiuto di un batterio vettore (Agrobacterium tumefaciens). “Il problema è che ci sono varietà recalcitranti, per cui è molto difficile rigenerare un’intera pianta dalla cellula editata”, spiega il genetista vegetale. Poi per eliminare la cassetta genetica, lasciando solo la mutazione desiderata senza DNA extra, si seguono strade diverse a seconda della pianta. Se è una specie annuale (con linee pure) il 25% delle piante editate è privo di transgeni, quindi si può procedere all’autoimpollinazione. Se la specie editata con l’aiuto dell’agrobatterio è pluriennale, invece, si può ricorrere a un passaggio biotech che sfrutta il calore per espellere il DNA estraneo.
“L’alternativa è fornire CRISPR/Cas9 sotto forma di complesso proteico con la sua RNA guida in un passaggio delicato usando prodotti a protezione della cellula in coltura, così si evita lo step della rimozione del DNA estraneo”, aggiunge Velasco. Restano però il problema della coltura tissutale che allunga i tempi e complica il cammino, soprattutto per le specie resistenti a trasformazione genetica e rigenerazione, tra cui le piante leguminose come la soia e la maggioranza degli alberi da frutto.
In alcuni casi non basta spegnere un gene indesiderato con l’editing, ma è necessario inserire un gene utile proveniente da una varietà sessualmente compatibile (si parla di cisgenesi, anziché di transgenesi, se il gene avrebbe potuto essere trasferito mediante incrocio). Con un processo biotech e l’aiuto del calore è possibile rimuovere le sequenze indesiderate della cassetta genica lasciando il gene desiderato, che avrebbe potuto essere introdotto anche con metodi convenzionali. “L’escissione delle sequenze lascia tracce minime, del tutto simili a fenomeni naturali, perciò non avrebbe senso considerare queste piante alla stregua di quelle transgeniche”, sostiene Velasco.
“L’editing by grafting con CRISPR mobile è un’ingegnosa novità che arricchisce la cassetta degli strumenti dei breeder. Dovrà essere perfezionato per quanto riguarda l’efficienza ma sono fiduciosa che funzionerà”, ci ha detto Rosa Rao, che all’Università di Napoli usa il grafting proprio per studiare come viaggiano i segnali da una parte all’altra delle piante, ad esempio quando il pomodoro è attaccato da microrganismi patogeni.
La regina cinese delle agrobiotecnologie Caixia Gao, che ha firmato insieme a Jiacheng Hu il pezzo di commento su Nature Biotechnology, ritiene che l’approccio sarà facilmente applicabile alle piante compatibili con innesti di Arabidopsis, come pomodoro e rapa. Altre piante come frumento e riso, però, non hanno ancora protocolli di innesto ben stabiliti. “Al CREA vorremmo mettere alla prova l’idea con specie e varietà per cui è particolarmente difficile fare trasformazione e coltura in vitro. Abbiamo un progetto che potrebbe coinvolgere le unità olivicoltura e frutticoltura oltre che viticoltura. Se riuscissimo in piante come pesco e olivo sarebbe un risultato straordinario”, conclude Velasco.